危機應(yīng)對與應(yīng)急遞交機制 在公共衛(wèi)生緊急事件(如COVID-19)中,EMA允許簡化eCTD序列,優(yōu)先審評關(guān)鍵模塊并暫緩非數(shù)據(jù)。申請人可通過快速通道(Fast Track)提交疫苗或藥物的eCTD資料,審評周期可壓縮至6個月。此類申請需附風險評估報告,并承諾后續(xù)補交完整數(shù)據(jù)。 數(shù)據(jù)安全與長期存檔 歐盟要求eCTD資料存檔期限至少為藥品上市后30年,EMA采用分布式存儲和區(qū)塊鏈技術(shù)確保數(shù)據(jù)不可篡改。申請人需定期備份本地副本,并使用符合GDPR要求的加密傳輸協(xié)議(如AS2)遞交。歷史數(shù)據(jù)的遷移和格式轉(zhuǎn)換(如NeeS轉(zhuǎn)eCTD)需遵循特定技術(shù)規(guī)范。 環(huán)保效益與可持續(xù)發(fā)展 eCTD取代紙質(zhì)遞交后,歐盟每年減少約500噸紙張消耗,審評流程的數(shù)字化降低碳足跡約30%。虛擬審評會議和電子簽名進一步減少了差旅需求,契合歐盟2050碳中和目標。未來,eCTD4.0將通過數(shù)據(jù)壓縮技術(shù)進一步降低服務(wù)器能耗。美國注冊鄧白氏號申請相關(guān)技術(shù)支持。安徽仿制藥eCTD服務(wù)價格
多國審評程序與eCTD遞交途徑的適配:歐盟藥品審評程序包括集中(CP)、分散(DCP)、互認(MRP)和國家程序(NP),eCTD需適配不同程序的遞交要求。例如: 集中審評程序(CP):通過EMA的eSubmission Gateway提交,審評時限約240個工作日,eCTD需包含完整的模塊1-5及多語言標簽文件。 分散審評程序(DCP):需通過CESP(歐盟共同提交門戶)遞交,參考成員國(RMS)主導(dǎo)審評,eCTD需支持多國同步評估的模塊化拆分。 互認程序(MRP):已授權(quán)成員國作為RMS,eCTD需包含基線序列(Baseline Sequence 0000)以整合歷史審評數(shù)據(jù),并通過CMDh協(xié)調(diào)分歧。安徽仿制藥eCTD服務(wù)價格美國eCTD驗證標準相關(guān)技術(shù)支持。
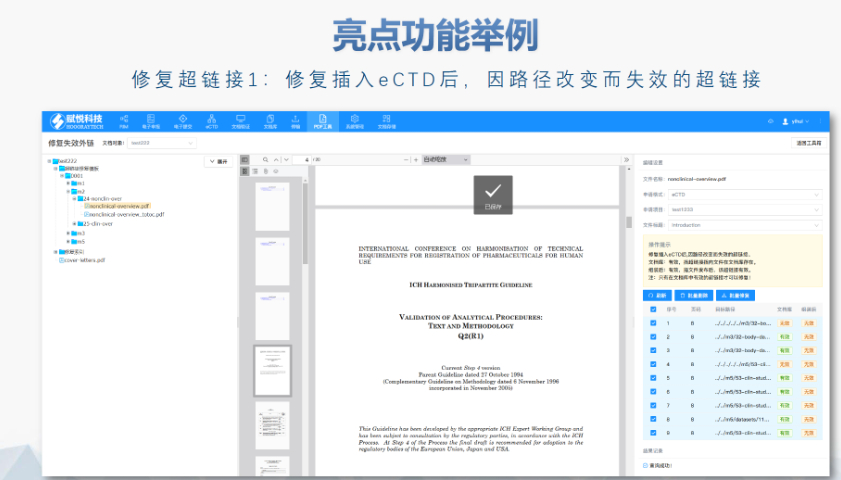
eCTD生命周期管理與變更提交:歐盟要求eCTD申報資料覆蓋藥品全生命周期,包括提交、補充申請及實質(zhì)性變更。例如,增成員國需提交“附加成員國序列”,審評時間約52-83天;重大變更(如生產(chǎn)工藝調(diào)整)需創(chuàng)建序列并通過CTIS平臺更模塊3和模塊1的GMP證明。技術(shù)驗證工具(如EDQM推薦的檢查軟件)需在每次提交前運行,確保XML骨架文件與PDF書簽層級符合規(guī)范。此外,電子簽章需符合《歐盟電子簽名法》,并在模塊1中明確標注法律效力。歐洲通用提交門戶(Common European Submission Portal,CESP)是歐盟及成員國藥品監(jiān)管機構(gòu)間用于電子化提交申報資料的重要平臺。以下是關(guān)于CESP的詳細介紹: CESP是由歐盟藥品監(jiān)管部門負責人網(wǎng)絡(luò)(HMA)合作開發(fā)的在線交付系統(tǒng),旨在為藥品注冊申請者、利益相關(guān)方和監(jiān)管機構(gòu)之間提供統(tǒng)一、安全的電子提交通道。其設(shè)計初衷是簡化跨國申報流程,允許通過單一門戶向多個歐洲國家的藥監(jiān)部門同時提交申請,避免了重復(fù)操作。
FDA圍繞eCTD發(fā)布了10余項法規(guī)指南,涵蓋格式要求、文件生命周期、數(shù)據(jù)安全等細節(jié),其中《ICH M2 EWG》作為綜合性技術(shù)文件,成為企業(yè)申報的參考。eCTD的實施提升了審評效率,通過標準化XML結(jié)構(gòu)和電子簽章技術(shù),減少了紙質(zhì)遞交的物流與時間成本,同時支持全生命周期管理,便于后續(xù)變更和補充資料的動態(tài)更。 美國在eCTD實施中注重與ICH國際標準的兼容性,例如采用統(tǒng)一的CTD模塊化結(jié)構(gòu)和PDF技術(shù)規(guī)范。然而,其區(qū)域性要求(如信封信息中的Application ID、Submission Subtype)仍體現(xiàn)本土化特色。這種“國際框架+本地適配”的模式,既保障了跨國藥企的申報便利,又滿足了FDA的監(jiān)管需求。歐盟eCTD注冊外包相關(guān)技術(shù)支持。
eCTD在歐盟藥品監(jiān)管中的歷史背景:歐盟eCTD(電子通用技術(shù)文檔)的發(fā)展始于對臨床試驗和藥品審評流程標準化的需求。2001年,歐盟引入《臨床試驗指令》(CTD)作為統(tǒng)一的法律框架,但其分散的成員國申報機制導(dǎo)致效率低下。2014年,歐盟通過《臨床試驗法規(guī)》(CTR, Regulation EU No. 536/2014),要求通過CTIS平臺(臨床試驗信息系統(tǒng))集中提交臨床試驗申請(CTA),并逐步推動eCTD作為電子化申報的工具。這一旨在解決傳統(tǒng)CTD模式下審評周期長、多國協(xié)調(diào)成本高的問題,為eCTD的實施奠定了基礎(chǔ)。eCTD注冊咨詢相關(guān)技術(shù)支持。上海ANDAeCTD遞交
瑞士NDA注冊申報相關(guān)技術(shù)支持。安徽仿制藥eCTD服務(wù)價格
DMF維護與合規(guī) 年度更 即使無變更,每年需提交聲明;重大工藝/設(shè)施變更需及時通知客戶并更文件。 現(xiàn)場檢查 原料藥企業(yè)需通過FDA現(xiàn)場檢查,驗證是否符合ICH Q7 GMP標準,并與DMF內(nèi)容一致。 轉(zhuǎn)讓與關(guān)閉 轉(zhuǎn)讓:需書面通知FDA并提供持有者信息。 關(guān)閉:未提交年度報告或持有人主動申請,需說明原因并通知所有授權(quán)方。 關(guān)鍵注意事項 數(shù)據(jù)質(zhì)量:所有資料需準確、完整,減少審核延遲風險。 合規(guī)性:遵循FDA指南(如21 CFR Part 207)及USP標準(如培養(yǎng)基物料來源級別)。 溝通機制:建議通過專業(yè)機構(gòu)(如瑞歐佰藥)協(xié)助,定期提交周報并制定計劃表以提高效率。 常見問題解答 生物制品分類:培養(yǎng)基、外泌體等均屬Ⅱ類DMF。 質(zhì)量標準:參考USP及同行標準,需提供分析方法驗證及雜質(zhì)對比研究。 周期估算:資料準備約5-50個工作日,總周期受缺陷回復(fù)影響。安徽仿制藥eCTD服務(wù)價格
賦悅科技(杭州)有限責任公司是一家有著雄厚實力背景、信譽可靠、勵精圖治、展望未來、有夢想有目標,有組織有體系的公司,堅持于帶領(lǐng)員工在未來的道路上大放光明,攜手共畫藍圖,在浙江省等地區(qū)的數(shù)碼、電腦行業(yè)中積累了大批忠誠的客戶粉絲源,也收獲了良好的用戶口碑,為公司的發(fā)展奠定的良好的行業(yè)基礎(chǔ),也希望未來公司能成為行業(yè)的翹楚,努力為行業(yè)領(lǐng)域的發(fā)展奉獻出自己的一份力量,我們相信精益求精的工作態(tài)度和不斷的完善創(chuàng)新理念以及自強不息,斗志昂揚的的企業(yè)精神將引領(lǐng)賦悅科技供應(yīng)和您一起攜手步入輝煌,共創(chuàng)佳績,一直以來,公司貫徹執(zhí)行科學(xué)管理、創(chuàng)新發(fā)展、誠實守信的方針,員工精誠努力,協(xié)同奮取,以品質(zhì)、服務(wù)來贏得市場,我們一直在路上!