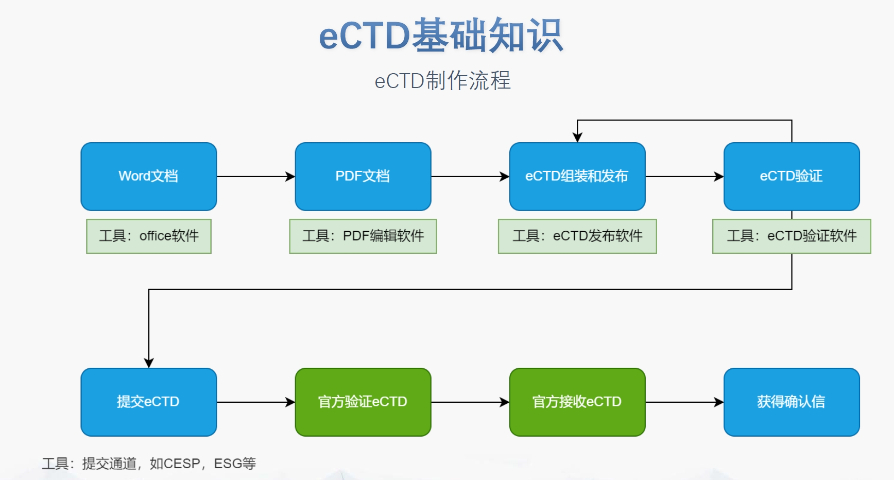
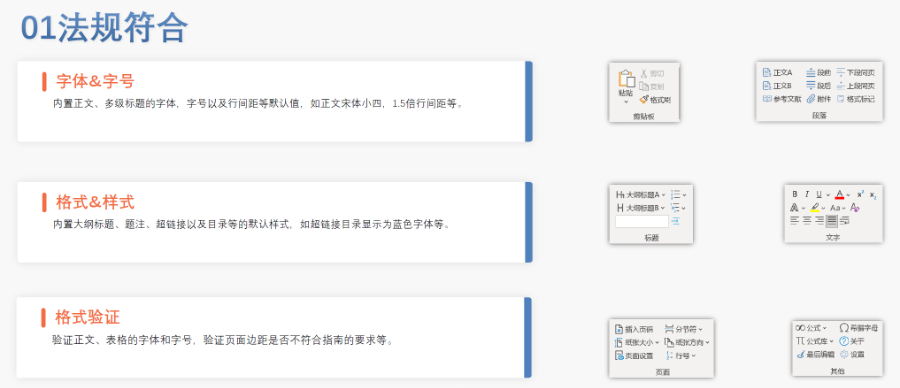
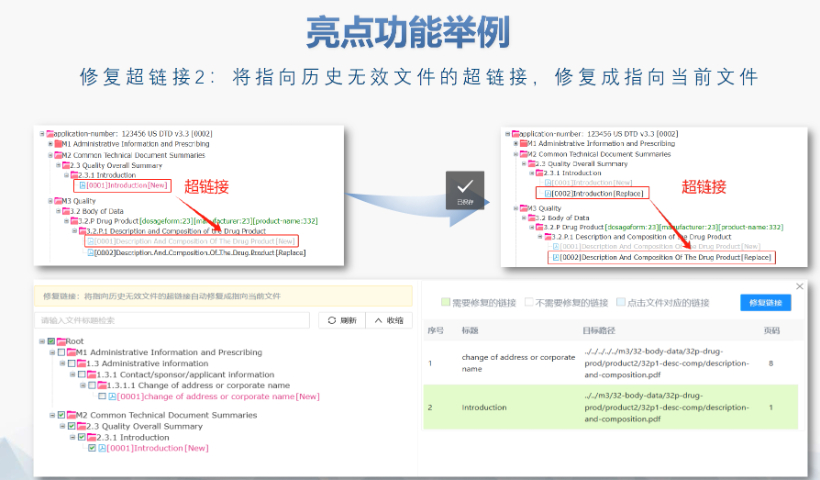
生命周期管理與變更遞交 eCTD支持全生命周期管理,申請(qǐng)人需通過序列更(Sequence)反映藥品變更信息。例如CEP證書的更需提交“變更說明表”,對(duì)比已批準(zhǔn)和擬修改內(nèi)容,并附修訂版技術(shù)文檔。重大變更(如生產(chǎn)工藝調(diào)整)可能觸發(fā)GMP現(xiàn)場檢查,EDQM將根據(jù)風(fēng)險(xiǎn)評(píng)估決定是否啟動(dòng)核查。 電子簽名與法律效力 歐盟接受符合《電子簽名法》的數(shù)字簽名,手寫簽名的掃描件需嵌入PDF并加密保護(hù)。模塊1的申請(qǐng)表和承諾書必須包含有效簽名,且XML文件需通過MD5校驗(yàn)確保完整性。若使用第三方簽署工具,需提前向監(jiān)管機(jī)構(gòu)報(bào)備并獲取技術(shù)認(rèn)可。 中小企業(yè)支持與資源獲取 EMA和EDQM為中小企業(yè)提供eCTD實(shí)施指南、驗(yàn)證工具及培訓(xùn)研討會(huì)。例如,EDQM官網(wǎng)發(fā)布CEP遞交模板和案例庫,EMA則定期更Q&A文檔以解答常見問題。此外,歐盟設(shè)立專項(xiàng)基金,資助中小企業(yè)完成eCTD轉(zhuǎn)換和系統(tǒng)部署。澳大利亞IND注冊(cè)申報(bào)相關(guān)技術(shù)支持。安徽eCTD推薦
eCTD的技術(shù)架構(gòu)與模塊要求:美國eCTD基于XML技術(shù),嚴(yán)格遵循ICH M4框架,分為5個(gè)模塊:模塊1(地區(qū)行政信息)、模塊2(技術(shù)總結(jié))、模塊3-5(質(zhì)量、非臨床與臨床數(shù)據(jù))。其中,模塊1需包含F(xiàn)DA特定的us-regional.xml文件,涵蓋申請(qǐng)編號(hào)、聯(lián)系人和DMF授權(quán)書等行政信息。模塊2-5需與ICH CTD全球統(tǒng)一標(biāo)準(zhǔn)一致,但FDA對(duì)文件顆粒度要求更細(xì),例如非臨床研究報(bào)告需拆分并標(biāo)記Study ID。PDF文件需符合FDA v4.1格式規(guī)范,包括字體嵌入、書簽層級(jí)和超鏈接功能。浙江藥品注冊(cè)eCTD性價(jià)比美國eCTD注冊(cè)咨詢相關(guān)技術(shù)支持。
美國eCTD驗(yàn)證采用三級(jí)分類:“錯(cuò)誤”(必須修正)、“警告”(建議修正)、“提示信息”(參考)。例如,PDF文件版本不符或加密保護(hù)屬于“錯(cuò)誤”,而書簽路徑非相對(duì)性則可能列為“警告”。驗(yàn)證失敗將直接導(dǎo)致退審,企業(yè)需通過LORENZ Validator等工具預(yù)檢,確保提交前合規(guī)。 技術(shù)驗(yàn)證點(diǎn) 驗(yàn)證涵蓋XML結(jié)構(gòu)合規(guī)性、文件命名規(guī)則、生命周期管理(如序列號(hào)連續(xù)性)及PDF屬性(如字體嵌入、可搜索性)。臨床試驗(yàn)數(shù)據(jù)需額外滿足CDISC標(biāo)準(zhǔn),包括SDTM和ADaM數(shù)據(jù)集的結(jié)構(gòu)驗(yàn)證
PDF工具箱 批量處理與格式修復(fù) 支持PDF合并、拆分、提取頁面、旋轉(zhuǎn)頁面等操作,可批量修復(fù)字體未嵌入、超鏈接錯(cuò)誤等問題,確保文件符合藥品注冊(cè)法規(guī)要求。 智能書簽與超鏈接管理 提供書簽導(dǎo)入/導(dǎo)出、超鏈接自動(dòng)生成(支持關(guān)鍵字搜索定位鏈接)、題注超鏈接拖拽式編輯等功能,簡化復(fù)雜文檔的導(dǎo)航設(shè)計(jì)。 文檔轉(zhuǎn)換與OCR識(shí)別 支持Word轉(zhuǎn)PDF(自動(dòng)生成書簽、嵌入字體),以及PDF與Word、Excel等格式互轉(zhuǎn),集成OCR功能用于掃描件文字識(shí)別。 合規(guī)性驗(yàn)證 自動(dòng)驗(yàn)證PDF的頁面布局、頁碼連續(xù)性、空白頁、目錄層級(jí)等屬性,并定位具體錯(cuò)誤位置,減少人工檢查成本。 安全與協(xié)作功能 支持文檔加密、數(shù)字簽名、云端同步及多設(shè)備共享,滿足企業(yè)級(jí)文件安全管理需求。加拿大eCTD申報(bào)軟件相關(guān)技術(shù)支持。
2015年發(fā)布《關(guān)于藥品醫(yī)療器械審評(píng)審批制度的意見》,提出藥監(jiān)五大目標(biāo),將eCTD納入國家藥監(jiān)數(shù)字化戰(zhàn)略。2017年,中國加入ICH(國際人用藥品注冊(cè)技術(shù)協(xié)調(diào)會(huì)),成為全球第八個(gè)監(jiān)管機(jī)構(gòu)成員,加速與國際標(biāo)準(zhǔn)接軌。2018年,國家藥監(jiān)局(NMPA)完成eCTD文檔管理系統(tǒng)招標(biāo),由上海寶信與德國LORENZ合作搭建技術(shù)平臺(tái),標(biāo)志著技術(shù)基礎(chǔ)設(shè)施的落地。 規(guī)范制定與試點(diǎn)階段(2019-2023年) 2019-2020年,CDE(藥品審評(píng)中心)發(fā)布《eCTD技術(shù)規(guī)范》《驗(yàn)證標(biāo)準(zhǔn)》等征求意見稿,并組織兩輪企業(yè)測試。2021年,NMPA明確化學(xué)藥1類、5.1類及生物制品1類上市申請(qǐng)適用eCTD。2022年實(shí)施電子申報(bào)(非eCTD格式),2023年取消紙質(zhì)資料提交,為eCTD鋪開奠定基礎(chǔ)。 實(shí)施與擴(kuò)展階段(2024-2025年) 2024年3月更電子申報(bào)技術(shù)要求,7月啟動(dòng)網(wǎng)絡(luò)傳輸試點(diǎn)。2025年1月27日,NMPA將eCTD適用范圍擴(kuò)大至化藥1-5類臨床試驗(yàn)及上市申請(qǐng)、生物制品1-3類全流程,覆蓋藥、仿制藥及生物類似藥,實(shí)現(xiàn)與國際主流申報(bào)模式同步。加拿大eCTD注冊(cè)外包相關(guān)技術(shù)支持。浙江藥品注冊(cè)eCTD性價(jià)比
美國IND注冊(cè)申報(bào)相關(guān)技術(shù)支持。安徽eCTD推薦
歐洲藥品管理局:集中審評(píng)程序由歐洲藥品管理局(European Medicines Agency, EMA)負(fù)責(zé)協(xié)調(diào)。 人用藥品委員會(huì):人用藥品委員會(huì)(Committee for Medicinal Products for Human Use, CHMP)負(fù)責(zé)提供科學(xué)意見。 歐盟委員會(huì):CHMP的意見隨后被提交給歐盟委員會(huì)(European Commission, EC),由歐盟委員會(huì)做出是否授權(quán)的終決定。這個(gè)決定在整個(gè)歐盟都是具有法律約束力的。 審批過程: 申請(qǐng)人向EMA提交申請(qǐng),包括eCTD(電子通用技術(shù)文檔)格式的藥品注冊(cè)文檔。 EMA的CHMP分配一個(gè)科學(xué)評(píng)估團(tuán)隊(duì)(Rapporteur和Co-Rapporteur),負(fù)責(zé)初步評(píng)估。 CHMP基于評(píng)估團(tuán)隊(duì)的報(bào)告提供科學(xué)意見。 歐盟委員會(huì)根據(jù)CHMP的意見做出終決定,批準(zhǔn)或拒絕藥品上市。 授權(quán)范圍 如果藥品獲得批準(zhǔn),將獲得在整個(gè)歐盟、冰島、列支敦士登和挪威有效的上市許可(Central Marketing Authorisation, CMA)。安徽eCTD推薦