合肥M-SAN HQ中鹽核酸酶采購
在生物工藝流程中,需要使用核酸酶去除終產品中的核酸污染,而核酸酶作為外源成份,也需要在生產流程中去除。核酸酶去除工藝包括熱滅活法、酶抑制劑、離子交換和親合層析法等。慢病毒LV的pI在6.0-6.5左右,包裝了完整基因組DNA后的AAV病毒顆粒PI大致為5.9,來自于S.marcescens的全能核酸酶pI 6.85左右,M-SAN HQ中鹽核酸酶pI 8.7左右。因此,在同樣的條件下,從LV/AAV溶液中去除M-SAN HQ中鹽核酸酶比去除Benzonase全能核酸酶更容易、更徹底。徐州中鹽核酸酶售后服務哪家好呢,歡迎咨詢上海倍篤生物 。合肥M-SAN HQ中鹽核酸酶采購

細胞基因藥物的基因遞送有病毒及非病毒兩種方式,其中病毒遞送更為常用。在病毒遞送路徑中,腺相關病毒(AAV)和慢病毒(Lentivirus)是常用的兩種載體;差別是病毒基因組的存在形式,AAV的基因組一般不整合到染色體中,以游離形式存在于染色體之外,且一般會表達數年之久;而慢病毒的基因組則會整合到染色體達到長期持續表達的目的。此外,其它用于基因藥物的病毒載體有單純皰疹病毒(HSV)、痘苗病毒(Vaccina Virus)、痘病毒(Poxviruses)。寧波70950-160中鹽核酸酶采購M-SAN HQ ELISA Kit能夠定量檢測M-SAN HQ中鹽核酸酶殘留。
除了獲得載體的滴度及產量,生產慢病毒更關心的指標主要是各種污染物的去除。總DNA污染的去除百分比在99.1-99.84%,總蛋白污染物的去除百分比在99.85-99.9%。針對宿主細胞的DNA(HCD)及蛋白(HCP),有報道其去除百分比分別為99.8%和99.4%。因為不僅殘存的DNA可能是個問題,而且DNA的大小以及由此引起的可能轉移整個有功能的開放閱讀框也是問題,因此監管機構對殘存DNA污染的分子量上限的要求越來越高。例如,FDA的指南‘生產用于傳染病適應癥的病毒疫苗的細胞基質和其他生物材料的特性和鑒定’中說明,殘留的細胞宿主的DNA片段不能超過一個功能基因的長度,估計在200bp左右。
ArcticZymes Technologies致力于提供高質量產品,具有良好的批間一致性、穩定可靠的質量、及時的文件及技術支持。ArcticZymes所有產品的開發、生產及銷售等都符合ISO13485:2016質量管理體系標準;鑒于生物制品更嚴格的質控要求,廠家對鹽活性核酸酶系列產品(Salt Active Nucleases,SANs)的生產及質控,在符合ISO13485:2016體系基礎上,增加了cGMP相應要求,如生產用原輔料是Non-animal和Non-plant來源的,終產品經過0.22μm過濾sterilization,放行檢測包括microbes、fungus及內毒檢測等,所有標準符合USP-EP要求。M-SAN HQ中鹽核酸酶生產符合ISO 13485:2016規范,提供相關文件用于申報。
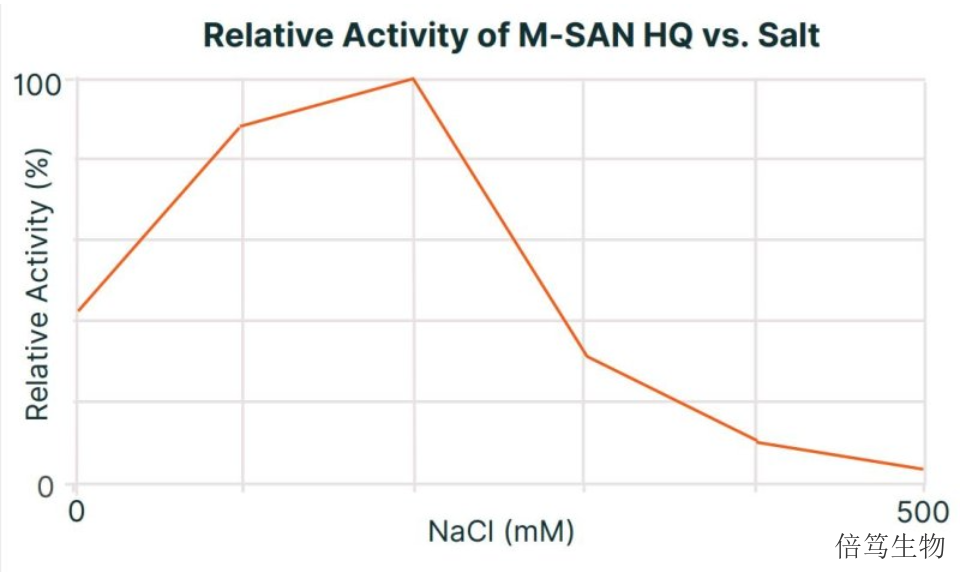
ArcticZymes廠家對鹽活性核酸酶系列產品(Salt Active Nucleases,SANs)的生產及質控,包括SAN HQ高鹽核酸酶和M-SAN HQ中鹽核酸酶,在符合ISO13485:2016體系基礎上,增加了cGMP質控標準,如microbes、endotoxin、蛋白酶等;同時提供TSE/BSE聲明、無動物源(Animal-Origin Free)聲明、非轉基因聲明等文件協助藥物申報。此外,ArcticZymes的生產場地接受客戶的定期審計,其第三方審計文件已得到國際TOP CDMO及Biotech的認可,并已經成為國際TOP CDMO的供應商。具體文件體系可以跟廠家或對應銷售人員聯系。中鹽核酸酶適宜pH范圍廣(pH7.2-8.7),且在125–250mM鹽濃度內具有較高活性。鹽城70950-202中鹽核酸酶
M-SAN HQ中鹽核酸酶終產品經過0.22μm過濾;合肥M-SAN HQ中鹽核酸酶采購
核酸酶活性受到很多因素影響,如鹽濃度、pH、底物、溫度等。因此,不同客戶、不同項目中核酸酶的使用條件都不一。目前,生物制藥行業對Benonase全能核酸酶的使用比較熟悉,如生理鹽或低鹽濃度、脫鹽操作等。對于大部分使用Benzonase的項目,使用M-SAN HQ中鹽核酸酶可以完全替代,而且溫度、Mg2+濃度等條件不用做任何調整,同樣酶量的M-SAN HQ對宿主細胞DNA(HCD)的去除效果更好、病毒載體得率更高。經過工藝優化后,可以將M-SAN HQ中鹽核酸酶的用量減少到原來的1/3-1/2,且HCD去除效果及產品得率更高。合肥M-SAN HQ中鹽核酸酶采購
- 吉林倍篤生物中鹽核酸酶 2025-07-24
- 重慶70950-160中鹽核酸酶哪家公司銷售 2025-07-24
- 天津在線中鹽核酸酶廠家直銷 2025-07-24
- 黑龍江智能中鹽核酸酶價格表 2025-07-24
- 青海70950-150中鹽核酸酶價格 2025-07-24
- 廣東70950-202中鹽核酸酶國內代理 2025-07-24
- 天津哪些中鹽核酸酶價格 2025-07-24
- 四川倍篤生物中鹽核酸酶量大優惠 2025-07-24
- 黑龍江綜合中鹽核酸酶量大優惠 2025-07-24
- 山東倍篤生物中鹽核酸酶哪家公司銷售 2025-07-24
- 成都推薦洗鼻鹽批發廠家 2025-07-24
- 品質蛋白質組學研究服務 2025-07-24
- 普陀區細胞耗材什么價格 2025-07-24
- 天津熱塑管一次性生物耗材電話多少 2025-07-24
- 買平衡分析 2025-07-24
- NK細胞外泌體價格 2025-07-24
- 廣東鹽水鼻腔沖洗液代加工 2025-07-24
- 山東4-甲基傘形酮磷酸酯 二鈉鹽 2025-07-24
- 四川TOC清潔驗證棉簽檢測 2025-07-24
- 內窺鏡有哪些 2025-07-24